
文章概要
光转化荧光蛋白 (PCFPs) 能随激发光波长地改变发出不同颜色的荧光,这类荧光蛋白极大地促进了活细胞超高分辨显微成像技术(PALM)的发展及应用。光转化荧光蛋白(PCFPs)的光转化机理一直是许多实验和理论研究的热点,对于PCFPs的光致变色和红光闪烁都得到了广泛的研究,但其绿光物理行为却很少受到关注。然而,在显微镜成像中,发现绿色PCFPs中的暗态会变得非常密集,并且会间接地影响到红色通道中记录的数据质量。此外,PCFPs中的绿态光开关可直接用PALM,已被设计成高效可逆的光开关荧光蛋白 (RSFPs)。本文作者研究了绿色荧光蛋白mEos4b的发光机制,证明mEos4b和大多数RSFPs一样,依赖于荧光生色团可逆的顺反异构实现暗态和亮态之间的切换。然而,综合结晶动力学、分子动力学模拟和拉曼光谱的结果,作者发现绿色mEos4b中的暗态比关闭绿色IrisFP(一种双光色PCFP)中的暗态更为动态。数据表明,绿色PCFPs和RSFPs中的发色团在它们的亮/暗态状态下保持的氢键模式共同控制着光开关量子产率。因此,与IrisFP相比,绿色mEos4b中动态暗生色团维持的H键数目的减少,很大程度上解释了其较低的开关对比度。
研究内容
RSFPs的光开关是其关键的性能参数,在很大程度上决定了RSFPs可达到的分辨率。因此,评价RSFPs中控制开关对比度的机制具有重要意义,作者对绿色mEos4b的光开关进行了研究。绿色mEos4b中长寿命的暗态研究结果如图1所示,其中暗态形成的特征(图1A)是阴离子发色团的吸收带衰减,峰值在504nm,质子化发色团的吸收带上升,峰值在390nm。为了探讨绿色mEos4b与长寿命暗态形成相关的机制,作者使用结晶动力学方法研究它们的开关行为,作者获得了一个2.4Å的暗态mEos4b晶体,并将所得的结构(灰色)与绿色荧光状态下的mEos4b(绿色)进行了比较,电子差密度图显示出明显的构象变化,表明生色团发生了顺反异构化(图1B)。绿色mEos4b中伴随暗态形成的结构变化与绿色珊瑚虫RSFPs中的结构变化基本相似(图1C、D),如dropa、pcdropa、IrisFP和mTFP0.7,这表明,尽管容纳反式发色团的空间有限,但都发生了类似的光开关机制。Ser142在顺式状态下与羟基苄叉部分建立一个强的H-键,一旦发色团异构化,就朝向周围的溶剂并在Glu158中找到一个补偿的H-键(图1D)。在反态发色团的质子化可以用静电环境相对于顺态的变化来解释。
在IrisFP中,Phe173Ser单点突变诱导Met159的重新定向,在发色团羟基苄叉环上方形成一个空穴,极大地促进发色团异构化。有趣的是,在mEos4b中是没有这样的口袋,但也可以发生异构化。因此,作者进一步研究了这种PCFP如何在反式结构中维持发色团。首先,作者注意到,与IrisFP相比,Glu144与发色团羟基苄叉部分的羟基之间的距离延长了(3.5Åvs 2.9Å),并且由该基团形成的唯一氢键涉及一个水分子(WAT403,2.5Å),水分子被Gly155、Glu144和Thr175紧紧地固定在原位。这造成了发色团与Glu144之间的相互作用减弱。此外,与IrisFP相比,保守的Glu212未与发色团的咪唑啉酮结构形成H键(图1D)。最后,与IrisFP(分别为−4°、40°和125°)相比,暗态时mEos4b中的发色团似乎采用了更高的倾斜和扭转二面体(分别为−25°、52°和130°)。全局精细化进一步支持了这一假设,即亮态结构以稳定的氨基酸构象为特征,而暗态发色团及其环境中构象比较多样化(图1E,F)。另外,值得注意的是,顺式构型中紧密结合的三联体Glu144−His194−Glu212被反式构型中的Glu144 −Arg66−Glu212三联体取代,His14或Arg66分别通过与羟基苄叉部分的π-堆积和π-阳离子相互作用来稳定发色团(图2)。
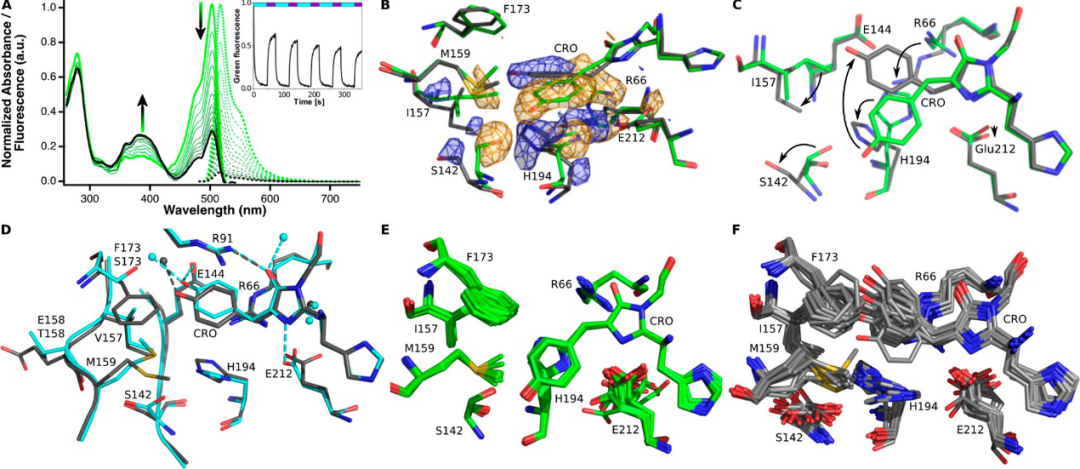
图1. 对绿色mEos4b中长寿命的暗态研究
图片来源JACS
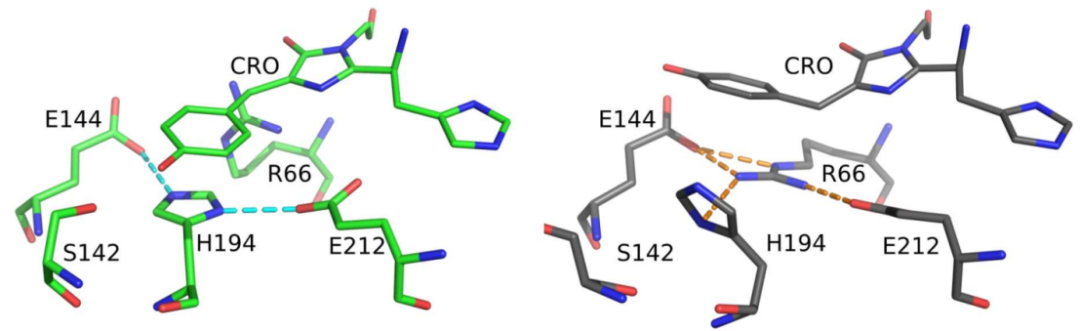
图2. mEos4b亮态(左)的Glu212-H194-Glu144和暗态(右)的Glu212-Arg66-Glu144之间的氢键模式
图片来源JACS
为了探索这种动态发色团在绿色mEos4b暗态(称为green off )中的机理基础,作者进行了MD模拟,并将结果与IrisFP的结果进行了比较。由于IrisFP是四聚荧光蛋白,作者对四条链都做了研究,晶体中每个链都能观察到两种不同的Ser142构象。在图3中,作者显示了最具代表性IrisFP构象的结果,值得注意的是,在mEos4b中,观察到暗态时发色团的倾斜和扭曲二面角有很大的变化,在两个主要亚态之间有跃迁(图3A)。这些转变在IrisFP中看不到,这表明在mEos4b中有一个更灵活的生色团,与周围的氨基酸和水分子有松散的连接,可以灵活地发生顺反异构。值得注意的是,由mEos4b的MD模拟得到的倾斜角和扭曲角的平均值低于从发色团的精细X射线结构中提取的值。作者尝试性地解释这一发现,因为后一种结构可能代表了多个平面构象的叠加。事实上,分子动力学模拟表明,mEos4b生色团在两种呈现不同H键模式的主要构象之间快速切换(图3B)。在第一构象(62%)中,羟苄叉氧(O3)与Glu144保持氢键,而在第二构象中,该键断裂并被与水分子(W1)的氢键取代。因此,O3交替地将其质子传递给Glu144或W1。在IrisFP的情况下,类似的MD模拟显示了O3将其质子传递给Glu144的高度优势构象(90%)。在mEos4b中,两个主要生色团构象之间的转换发生在几纳秒的时间内。然而,放大1ns的时间间隔(图3B,插图)显示,氢键断裂也发生在较小的时间尺度上,从几皮秒到几百ps。有趣的是,羟苄叉氧水平上的H键构象开关与倾斜和扭曲二面角的变化相关,如图3A、B所示。
根据在晶体结构中观察到的氢键三联体Glu144−Arg66−Glu212(图2),在所有mEos4b和IrisFP模拟中,Glu144−Arg66氢键都稳定存在。然而,Arg66-Glu212键的情况并非如此。在mEos4b中,Arg66(NH2)-Glu212(OE2)相互作用只存在41%的时间,而在IrisFP中,它几乎一直被破坏,水分子在模拟过程中一直介导着两个伙伴之间的相互作用。在IrisFP中,Arg66(NH2)与His194建立氢键,这导致两种蛋白质在发色团的咪唑啉酮结构周围的氢键模式不同。在IrisFP中,发色团的N15原子在86%的模拟时间内与Glu212相互作用(图3C)。此外,咪唑啉酮氧(O25)在43%的时间内保持与水分子的H键,此外还保持与Arg91的稳定H键。相反,在mEos4b中,咪唑啉酮部分除了与Arg91形成氢键外,没有其他氢键。
总体而言,MD模拟清楚地表明,与IrisFP相比,mEos4b中的暗态发色团不太稳定,这与基于晶体数据的细化结果一致。mEos4b中发色团在暗态下的动力学性质可与发色团口袋相邻残基所建立的氢键数目减少有关。在分子动力学模拟过程中,作者统计了羟苄叉氧、咪唑啉酮氧和咪唑啉酮氮(分别为O3、O25和N15原子)所建立的氢键的平均数目,mEos4b为2.5,而IrisFP为3.5。相比之下,从静态晶体学结构中提取的氢键数量分别为3.6和6.6(有关氢键计算的说明,请参见支持信息中的材料和方法)。这些更高的数字,尤其突出了H键相互作用的瞬态性质,这在X射线结构中是无法解释的。在mEos4b中发色团的弱锚定有助于在光激发时返回到亮态,因此解释了该PCFP相对较高的反向开关量子产率和较低的开关对比度。
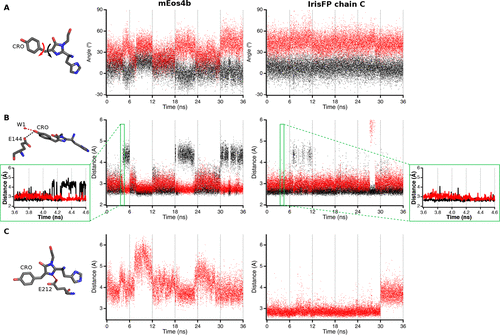
图3. 暗态下的绿色mEos4b和IrisFP分子动力学模拟结果对比
图片来源JACS
在mEos4b的红色状态下,作者观察到一种类似的涉及发色团异构化的光开关行为,在相应的暗态(称为red off)中,发现了一种所谓的“受挫”发色团,根据晶体数据,这种发色团的无序性甚至比在绿色暗态(green off)更大。两个暗态结构的叠加如图4所示。有趣的是,这两种结构之间的差异仅仅是由于Phe61的主链断裂和由光致变色引起的扩展电子共轭,而发色团绿色和红色mEos4b的环境基本保持不变。在Red off中,发色团的酚基与Glu144之间的距离现在大于4.2Å,这表明发色团完全失去了与Glu144的相互作用,这个作用在IrisFP稳定存在,在mEos4b的Green off中短暂出现。相反,发色团只能与水分子形成氢键。然而,Red off中保持了咪唑啉酮结构的氢键。因此,红色mEos4b中暗态的高动态性质可能不仅与连接发色团和β-桶的H键模式有关。更需要注意的是,与Green of f相比,Red off中主链断裂和氧化还原速率的扩展共轭也会导致发色团维持的静电相互作用的显著变化。例如,Green off的Arg66和发色团之间的π-阳离子相互作用在Red off被阻断,而是由另一个Arg91残基承担了该角色。除了氢键,静电相互作用也有助于发色团的稳定性,并在很大程度上决定了开关能力,作者推测发色团在mEos4b的Red off的动态性质是由弱氢键和静电相互作用的组合而来,这也可能是迄今为止在设计快速开关的红色RSFPs时遇到的困难有关。
为了研究不可逆光转换和可逆光开关对mEos4b基态结构动力学的影响,作者进一步收集了其绿色和红色以及相应的暗态拉曼光谱(图5)。值得注意的是,Green off 和Red off的拉曼光谱宽度显著增加(图5B)。作者将这种增加归因于暗态中的高动态发色团。值得注意的是,作者还发现绿色和红色mEos4b的低pH拉曼光谱也显示出增加的带宽,尽管幅度较小。这表明,通过光照或降低pH值使发色团质子化是失稳的主要原因。
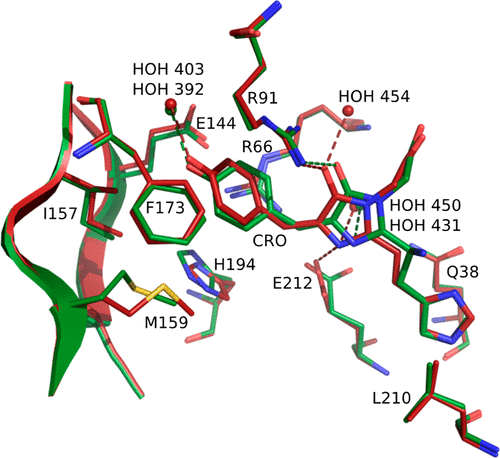
图4. 绿色和红色mEos4b中暗态的比较
图片来源JACS
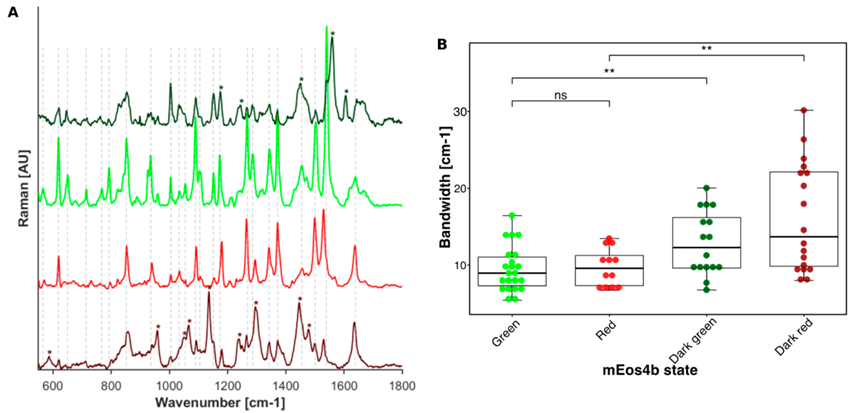
图5. mEos4b的拉曼特征
图片来源JACS
结论
本文的工作提供了PCFP复杂光物理的扩展图,并强调了由于生色团顺反异构化和质子化受阻而导致的mEos变体的显著的双光变色特性。这些数据揭示了发色团的颜色状态对可逆光开关的微妙影响,并指出绿色和红色mEos4b中光开关状态的高度动态特性。荧光蛋白的生色团的一个固有性质是在光激发。尽管荧光蛋白支架具有刚性,但这种异构化永远无法完全阻止,并最终形成反式发色团,而反式发色团可能被抑制,同时由于顺式和反式之间的高自由能垒(由异构化过程中的空间位阻引起)。作者推测,控制绿色RSFPs开关对比度的最重要因素之一是顺反态的相对稳定性,特别是通过每个态中发色团维持的H键数目。这一推测与超快速光谱实验一致,该实验强调了氢键相互作用如何控制细菌色素团的发色团异构化量子产率。比如,在Dronpa上进行的量子力学/分子动力学模拟也显示了对发色团构型的明-暗光开关更有利,其特征是低数量的氢键相互作用。由于开关量子产率与s1电子激发态的微观开关速率有关,因此它们的对数将随s1与路径过渡态之间的吉布斯自由能差ΔG*而定。如果在RSFP的亮、暗态下,H键通过提高或降低s0和s1的自由能对ΔG*有显著的贡献。图6A收集了所有PCFPs和RSFPs的数据,测量了它们的绿色亮、暗态下的结构和相应的开关量子产率,尽管进行了粗略的简化,但可以观察到整体显著的相关性,这一事实表明,在RSFPs中,氢键确实是控制开关量子产率的关键因素。如图6B和C所示,作者展示了一个拟议方案。与IrisFP相比,在两个方向上,mEos4b的暗,亮之间的跃迁势垒更高,这与mEos4b中较小的开关量子产率和较慢的热恢复一致。与IrisFP相比,mEos4b异构化过程中的空间位阻更大,这可能是后者中Phe173Ser突变的结果。然而,由于暗态自由能相对于亮态自由能的增加,在mEos4b中,暗-亮开关的速率相对于亮-暗开关的速率要高得多,主要归因于mEos4b暗态下氢键相互作用的数量较少。总之,本文的工作破译了在绿色mEos4b中起作用的主要开关机制。如本文所提出的,发色团和周围蛋白质残基之间的氢键模式在控制光开关中的关键重要性,最近也证明了静电相互作用的作用。在这两种相互作用的驱动下,生色团对于未来新型PTFPs的合理设计具有重要意义。
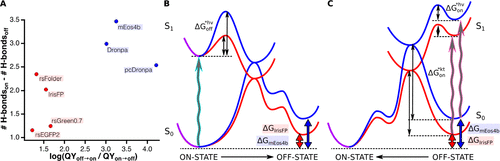
图6. RSFPs的生色团氢键与光开关量子产率之比之间的关系
图片来源JACS
参考文献:
Zitter E D , Ridard J , Daniel Thédié, et al. Mechanistic investigations of green mEos4b reveal a dynamic long-lived dark state. Journal of the American Chemical Society, 2020, DOI: 10.1021/jacs.0c01880